- Volgens onderzoekers kunnen mensen waarschijnlijk maximaal zo’n 150 jaar oud worden.
- Wereldwijd wordt er veel onderzoek gedaan naar veroudering van cellen, maar daar is nog een wereld aan kennis te winnen.
- Zaken als cellulaire veroudering, telomeerlengte en DNA-methylering blijken cruciaal bij verouderingsprocessen.
- Lees ook: Wat houdt je ‘biologische leeftijd’ precies in?
Mensen proberen al duizenden jaren om zo oud mogelijk te worden. Recentelijk is het streven naar ‘onsterfelijkheid’ iets dat opvallend veel miljonairs en miljardairs uit Silicon Valley bezighoudt.
Techmiljardairs zoals Larry Page, Mark Zuckerberg en Jeff Bezos hebben allemaal geïnvesteerd is biotech-startups die zich richten op het tegengaan van verouderingsprocessen.
Feit is dat, voor zover bekend, de oudste mens ooit een leeftijd van 122 jaar heeft gehaald. Mogelijk kan dat echter nog wat worden opgerekt.
Mensen kunnen mogelijk 150 jaar oud worden

Zelfs als je in een bubbel leeft zonder ziektes of gevaren, zal je lichaam slijten. Dat komt doordat het bloed rondpompt, voedsel verteert en allerlei andere functies uitvoert die nodig zijn om te overleven.
Hoe ouder je wordt, hoe moeilijker het wordt voor je lichaam om weer te herstellen van die slijtage. Veroudering ligt vast in onze cellen en DNA. Je weefsel verliest geleidelijk het vermogen zichzelf te genezen en dat kan leiden tot ziekte en het uitvallen van functies.
Uit onderzoek blijkt de hersteltijd van het menselijk lichaam elke 15 jaar verdubbelt. Dus een blauwe plek die op je veertigste in een week tijd geneest, doet daar op je vijfenvijftigste twee weken over. Uiteindelijk verliest het menselijk lichaam al zijn herstelvermogen en zal welke breuk of weefselbeschadiging dan ook blijvend zijn. Als er eenmaal teveel lichaamsfuncties zijn uitgevallen, kom je te overlijden.
Onderzoekers verschillen van mening wat de maximumleeftijd is waarop dit gebeurt. Sommigen zeggen dat 115 jaar de grens is en anderen 130 jaar. In een van de meest recente onderzoeken zijn meer dan een half miljoen mensen in de VS en het VK gevolgd en blijkt dat het herstelvermogen ergens tussen de 120 en 150 jaar helemaal verloren gaat.
De grote vraag is nu: wat als we die slijtage kunnen vertragen of beter nog helemaal voorkomen? Sommige experts denken dat er met de medische vooruitgang geen natuurlijke grens hoeft te zijn aan een mensenleven.
Laten we kijken hoe het verouderingsproces zich voltrekt op celniveau, wat ons tegenhoudt om langer te leven en hoe verschillende wetenschappers proberen het verouderingsproces beter te begrijpen en mogelijk om te keren.
Het verouderen van cellen wordt grondig onderzocht
Cellulaire veroudering leidt tot zogeheten 'senescente cellen' die zichzelf niet meer delen, maar ook niet doodgaan.
Sommige senescente cellen veranderen in schadelijke zombies, die rondzwerven door het lichaam en schade toebrengen aan gezonde cellen. Ook aan stamcellen, de "reparateurs" van je lichaam die helpen breuken en beschadigingen te herstellen.
Maar niet alle senescente cellen zijn slecht.
Sommige senescente cellen scheiden chemicaliën af die helpen bij het herstellen van wonden, zegt directeur Paul Robbins van het Institute on the Biology of Aging and Metabolism en het Medical Discovery Team on the Biology of Aging van de Universiteit van Minnesota.
Bedrijven als Life Biosciences en Unity Biotechnology zijn momenteel medicijnen aan het ontwikkelen genaamd 'senolytics' die alleen de slechte senescente cellen isoleren en vernietigen. Sommige experimentele medicijnen kunnen mogelijk zelfs voorkomen dat cellen senescent worden.
Maar tot nu toe is er nog niemand in geslaagd om schadelijke senescente cellen volledig te vernietigen of te voorkomen dat ze ontstaan.
Vanaf 60 jaar krijgt het menselijk lichaam — en dan met name het immuunsysteem — het zwaarder om schadelijke senescente cellen op te ruimen, zegt Robbins. Daardoor wordt de kans op problemen en het uitvallen van functies groter.
Een van de grootste oorzaken van het ontstaan van senescente cellen is schade aan je DNA, dat valt onder een heel ander onderzoeksgebied waar in 2009 een Nobelprijs voor werd uitgereikt: telomeren.
Telomeren helpen je biologische leeftijd in te schatten
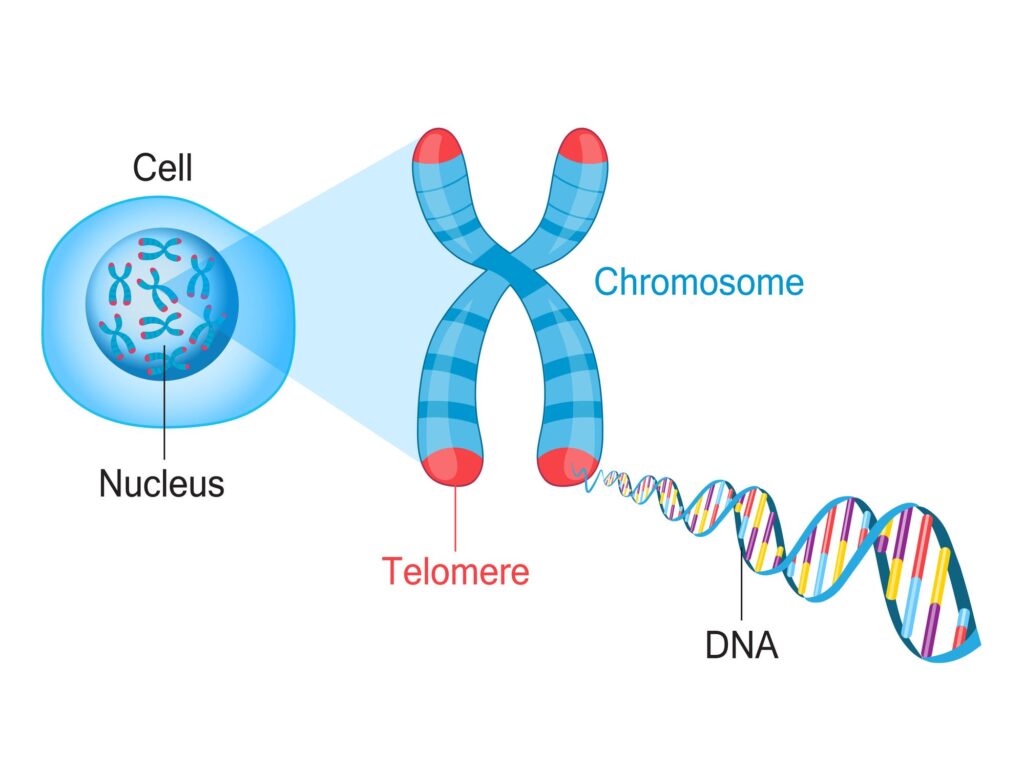
Sommige wetenschappers stellen dat je biologische leeftijd — hoe oud je cellen en je weefsel zijn — je levensverwachting beter in kan schatten dan je kalenderleeftijd.
Een gebruikelijke manier om je biologische leeftijd vast te stellen is het meten van de telomeren in bepaalde immuuncellen.
Telomeren zijn beschermende kapjes aan het eind van je DNA, volgens farmaceut Pfizer vergelijkbaar met het beschermlaagje om je schoenveters. Ze zijn gemaakt van reeksen moleculen, genaamd 'basenparen'. Als je ouder wordt verdwijnen die basenparen en worden de telomeren korter. Daardoor wordt je DNA kwetsbaarder voor schade.
Als je geboren wordt kunnen telemoren in sommige immuuncellen, genaamd leukocyten, tussen de 7.000 en 11.600 basenparen bevatten. Als dat aantal eenmaal zakt tot onder de 5.000 loop je een hoog risico om te overleden, blijkt uit recent onderzoek.
Maar uit ander onderzoek blijkt dat bij sommige mensen van boven de honderd de telomeren elk jaar juist langer worden in plaats van korter. Wetenschappers proberen dat herstelproces van telomeren nu ook voor elkaar te krijgen bij jongere mensen.
Zo heeft Aviv Clinics bijvoorbeeld een onderzoek uitgevoerd naar hoe vijfendertig oudere volwassenen reageerden op hyperbare zuurstoftherapie, waarbij je slaapt in een kamer met een hoge luchtdruk en een hoog zuurstofgehalte. Zij wisten de telomeren in de leukocyten van de deelnemers na dertig dagelijkse sessies te verlengen.
Maar de meeste telomeren stopten na de dertigste sessie met groeien en de onderzoekers weten niet hoe lang de effecten van hun behandeling in stand zullen blijven.
Verschillende ouderdomsziekten worden in verband gebracht met DNA-methylering

Een andere oorzaak van het ontstaan van senescente cellen en beschadigingen aan DNA is zogeheten DNA-methylering. Daarbij wordt een methylgroep van moleculen toegevoegd aan sommige delen van je genen en dat beïnvloedt de structuur van je DNA.
Afhankelijk van de plek in je lichaam kunnen de methylgroepen verhinderen dat genen worden geactiveerd of genactiviteit juist wordt versterkt als dat nodig is.
Over het algemeen neemt de DNA-methylering af als je ouder wordt en dat kan betekenen dat de verkeerde genen worden geactiveerd.
Onderzoek brengt de afname van methylering in verband met verschillende ouderdomsziekten, zoals Alzheimer, hart- en vaatziektes en kanker, hoewel het goed is op te merken dat niet alle veranderingen van methylering slecht zijn.
Net als bij telomeren kunnen wetenschappers aan de hand van DNA-methylering vaststellen wat je biologische leeftijd is en voorspellen hoe oud je wordt. Zo kan kunnen je cellen op je 55ste bijvoorbeeld al een methyleringsniveau van een zestiger hebben omdat je jarenlang gerookt hebt, waardoor je levensverwachting lager is.
Van oudsher wordt bij tests voor DNA-methylering gebruik gemaakt van bloed, maar bedrijven als Elysium Health en onderzoeksprojecten als GrimAge hebben onlangs ook speekseltesten ontwikkeld.
Mensen met een methyleringsleeftijd die minstens vijf jaar hoger ligt dan hun kalenderleeftijd hebben een 16 procent hoger overlijdensrisico,blijkt uit onderzoek.
Mitochondriën en vrije radicalen zijn grote obstakels voor een langer leven
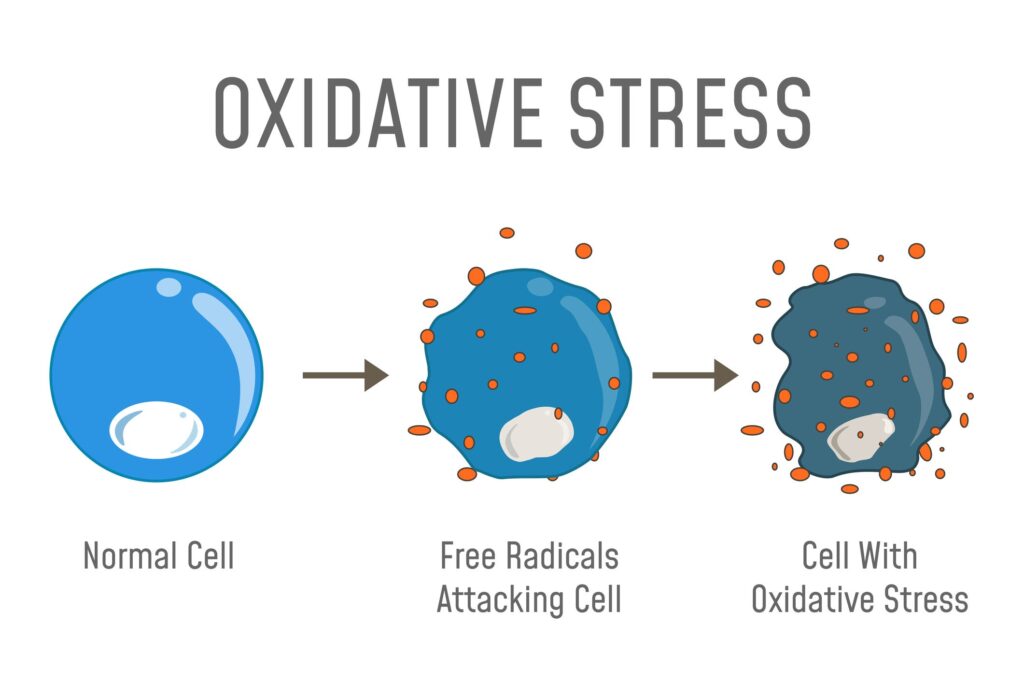
En tot slot zijn een van de grootste obstakels voor een lang even kleine boonvormige mitochondriën in je cellen. Die microscopische structuren genereren veel van de energie die een cel nodig heeft om te overleven, maar creëren ook bijproducten die vrije radicalen worden genoemd.
Vrije radicalen zijn instabiele atomen die rondzwerven en delen van je cellen kunnen beschadigen, waardoor zogeheten oxidatieve stress ontstaat. In de loop der tijd neemt die oxidatieve stress steeds verder toe, waardoor ziektes als Parkinson, Alzheimer en kanker kunnen worden veroorzaakt.
Biotechbedrijvan als Altos Labs werken aan manieren om deze ziektes te voorkomen door cellen te verjongen en de schade die oxidatieve stress toebrengt ongedaan te maken. Het bedrijf hoopt dat het 'resetten' van de cellen de levensduur kan verlengen.
Er is niet één oplossing in de zoektocht naar een lang leven
Voor ieder mechanisme dat bijdraagt aan ouder worden, zijn onderzoekers aan het werk om dat te begrijpen en die processen zo mogelijk een halt toe te roepen of zelfs om te draaien.
Maar het is belangrijk op te merken dat er niet één oplossing is voor de verouderingspuzzel. "Alle dingen die fout gaan bij het ouder worden, staan in verband met elkaar", zegt Robbins.
Zo kunnen kortere telomeren bijvoorbeeld leiden tot schade aan DNA en dat zorgt op zijn beurt weer voor problemen met je mitochondriën. En de vrije radicalen van je mitochondriën brengen vervolgens nog meer schade toe aan je telomeren en DNA. Als die processen beïnvloeden elkaar dus.
Het ene verouderingsmechanisme is niet belangrijker dan het andere. Daarom is al het ouderdomsonderzoek relevant, hoe niche ook. Want het draagt allemaal bij aan een van de grote doelen van de mensheid: zo lang mogelijk in leven blijven.
